ELEMENTO, COMPUESTO, MEZCLAS HOMOGENEAS Y MEZCLAS HETEROGENEAS.
Elementos.- Son sustancias químicas que están compuestas de un mismo tipo de átomo. Ejemplo: Al, Cl, Zinc, K, Cr, H y O etc.
Compuestos.- Son sustancias compuestas por más de un tipo de átomos. H2O y Cl Na etc.
Elementos químicos.- Son cuerpos simples con las que está constituida la materia, es decir, los elementos son sustancias formadas por una sola clase de átomo, con el mismo número atómico.
Sustancias.- Son los materiales con los que trabaja un químico u otro profesionista y pueden ser sustancias puras o no. Las sustancias puras se clasifican en elementos y compuestos. La mezcla de los elementos y compuestos se consideran no pura.
Mezcla.- Su composición es variable, está compuesta por más de una sustancia y sus componentes siempre podrán separarse, cuyas proporciones varían dependiendo del tipo de vegetación de la que provenga.
Ejemplos:CARACTERÍSTICAS DE LOS SISTEMAS DISPERSOS QUE ESTÁN PRESENTAES EN SU ENTORNO.
La mayoría de las sustancias con las que tenemos contacto diario, consisten en la mezcla de sustancias puras como la madera, papel, gasolina, perfumes, vino, tierra y aire son mezclas; algunas como el agua de mar son llamadas disoluciones, otras son sistemas coloidales como la leche, gelatina y otras son suspensiones como una atmosfera contaminada o polvorienta.
Ejemplos:MEZCLAS HOMOGENEAS Y HETEROGENEAS.Mezcla.- Su composición es variable y está compuesta por más de una sustancia. La madera es una mezcla de varias sustancias, con proporciones que varían dependiendo del tipo de vegetación de la que proviene el árbol.
Mezcla homogénea.- También denominadas disoluciones, se presentan en una sola fase que es la región de un sistema químico que presenta sustancias con características físicas y químicas definidas, se encuentra separada de otras regiones por interfaces en las cuales hay cambios súbitos en las propiedades físicas y químicas. Ejemplo: agua de mar formada por MgCl2, NaCl y CaCl2, aire formado por varios gases y bronce formado por cobre y zinc.
Mezcla heterogénea.- Tiene dos o más fases con propiedades diferentes, dependen de las propiedades del componente. Un ejemplo es el agua y el aceite, arena con azúcar, los granos de este último ejemplo se distinguen con una lupa y se pueden separar sin que haya ningún cambio químico, basta con lavar la mezcla con agua para que el azúcar se disuelva.
Ejemplos:METODOS DE SEPARACION DE MEZCLAS
La separación de mezclas es una tarea fundamental en el laboratorio y en el área industrial, ya que en nuestro planeta la mayoría de los materiales naturales se encuentran mezclados y hay que purificarlos. Existen mezclas sólidas, gaseosas y líquidas estas están en estado intermedio constituyen los sistemas de dispersión.
Decantación.- Se utiliza para separar un sólido de grano grueso e insoluble mezclado con un líquido. Ejemplo: El petróleo por ser menos denso permanece en la superficie superior del agua, luego de la decantación el agua se devuelve al mar.
Filtración.- Permite separar un sólido insoluble de grano relativamente fino que este mezclado con un líquido. Se emplea un medio poroso de filtración que deje pasar el líquido y retenga al sólido. Los filtros más comunes son: papel filtro, fibra de asbesto, algodón, fibra de vidrio, fibras vegetales, redes metálicas y cal.
Centrifugación.- Esta basado en la diferencia de densidades y se utiliza para separar un sólido insoluble, de grano muy fino y de difícil sedimentación que este mezclado con un líquido. Consiste en someter la mezcla a un rápido movimiento giratorio, separando las sustancias por diferencia de densidades. Se utiliza un aparato centrifugadora.
Destilación.- Es una forma de separar sustancias líquidas a partir de la diferencia en sus puntos de ebullición. Ejemplo: si se quiere separar una mezcla de alcohol y agua la ponemos al fuego, el punto de ebullición del alcohol es de 76ºC es menor que agua al nivel del mar que es 100ºC. Se calienta para que se evaporen y después se condensan para recuperarlos en su forma líquida. Tipos de destilación que hay: Destilación simple, fraccionada, arrastre de vapor y destilación al vacío. Ejemplos: industria se utiliza la destilación fraccionada para el petróleo (gasolina, turbosina, aceites lubricantes y asfalto) y el arrastre de vapor se utiliza para extraer l aceite de las semillas.
Cristalización.- Se refiere a la acción y efecto de cristalizar. Se pueden obtener y utilizar muchas sustancias en el laboratorio y en la industria. Ejemplo: Si fundimos y luego enfriamos lentamente el azufre este se cristaliza. Si sublimamos una sustancia y luego la condensamos sus vapores en una superficie fría se cristaliza.
Evaporación.- Separar un líquido de un sólido mediante el incremento de la temperatura. El líquido hierve o bulle y se transforma en vapor, quedando el sólido como residuo en forma de polvo seco, el componente líquido puede recuperarse o no.
Sublimación.- Paso de una sustancia de un estado sólido al estado gaseoso, sin pasar por el estado líquido. Se le aplica calor. Ejemplo las pastillas desodorantes para baño que aromatizan el ambiente y cambian de sólido al gaseoso.
Imantación.- Se utilizan para materiales que puedan ser atraídos por un campo magnético. Los materiales ferrosos, pueden ser separados de la basura por medio de un electroimán.
Solubilidad.- Separación de sólidos de líquidos o líquidos de líquidos al contacto con un solvente que reacciona con uno de los componentes de la mezcla. Se pueden hacer por decantación, filtración, evaporación, destilación etc. Ejemplo se utiliza frecuentemente en productos farmacéuticos.
Cromatografía.- Separar, con ayuda de solventes mezclados de gases o líquidos al conducirla a través de un medio poroso y adecuado. El equipo para tal operación puede ser una columna rellena de un papel o una placa que contiene el medio poroso, o bien un equipo tan sofisticado como lo es un cromatógrafo.
DISOLUCIÓN, COLOIDE Y SUSPENSIÓN CON BASE EN EL TAMAÑO DE PARTÍCULA DE LA FASE DISPERSA Y DISPERSORA.
Coloide.- Suspensión en un líquido de partículas más pequeñas que pasan a través del papel filtro. Pueden observarse con el ultramicroscopio.
Disolución.- Mezcla homogénea de dos o más componentes.
Suspensión.- Es una mezcla formada por un soluto en polvo o en pequeñas partículas no solubles y sediméntales en el líquido dispersor en que se encuentra.
Fase dispersa y dispersora.- Ejemplo cuando se deja caer un terrón de azúcar en un vaso con agua, las moléculas del agua se encargan de dispersar las moléculas del azúcar, de tal manera que esta última se distribuye o dispersa en el líquido. El agua es la fase dispersora y el azúcar es la fase dispersa.
Ejemplo:
Disoluciones sólidas.- Entre las más comunes se encuentran las aleaciones de dos o más metales, por ejemplo el bronce (cobre y estaño), el latón (cobre y zinc), acero (hierro, carbono, níquel y vanadio) etc.
Disoluciones líquidas.- El café está preparado con agua (disolvente líquido), café y azúcar (solutos sólidos), el refresco (disolvente líquido) que contiene azúcar, colorante, saborizante (solutos sólidos) y dióxido de carbono (soluto sólido). Muchos medicamentos son disoluciones líquidas, como el suero, las gotas para los ojos, nariz, oídos, los jarabes etc.
Disoluciones gaseosas.- Todos los gases son solubles entre sí de hecho la mezcla de gases más importante para los seres vivos es la atmósfera. Esta capa actúa como disolvente de muchos gases tóxicos, que emanan de las fabricas, los transportes y los hogares.
Diálisis.- Es la separación de dos o más sustancias mediante una membrana porosa en agua, la cual divide las sustancias cristalizables de las que no pueden efectuar dicho proceso. Ejemplo un riñón artificial.
Disolución acuosa.-Son mezclas homogéneas, puesto que por lo general se puede observar una sola fase formándolas. La primera fase dispersora disolvente en caso de deshidratación se aplica suero.

Problemas
1.- ¿Cuál será el porcentaje en masa de una disolución que se ha preparado disolviendo 30 gr de cloruro de potasio (KCl) en 120 gr de agua?
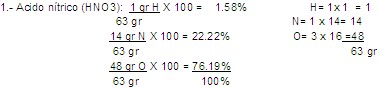
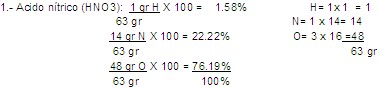
2.- ¿Qué cantidad de agua y alcohol necesitamos para preparar 150 ml de disolución acuosa de alcohol al 8%?
3.- ¿Cuál será el porcentaje en masa de una disolución que se ha preparado disolviendo 20 gr de cloruro de sodio (NaCl) en 115 gr de agua?
4.- ¿Cuál será el porcentaje en masa de una disolución que se ha preparado disolviendo 45 gr de cloruro de aluminio (AlCl3) en 95 gr de agua?
5.- ¿Qué cantidad de agua y soda necesitamos para preparar 120 ml de disolución acuosa de soda al 15%?
6.- ¿Qué cantidad de agua y acetona necesitamos para preparar 75 ml de disolución acuosa de acetona al 5%?
DENSIDAD
Se expresa la relación entre la masa y el volumen de una sustancia.
PROBLEMAS:
1.-¿Cuántos gramos pesa una barra de oro de 20 cm de longitud, 10 cm de ancho y 3.5 cm de altura? La densidad del oro es de 19.3 gr/cm.
Volumen= (20cm)(10cm)(3.5cm)= 700 cm
M= D X V M= (19.3 gr/ cm )(700 cm ) = 13.51 gr
2.- Los diamantes se cotizan en quilates y un quilate pesa .200gr. La densidad del diamante es de 3.51 gr/cm . El diamante hope pesa 44.5 quilates ¿Qué volumen ocupa esta famosa joya?


MOLARIDAD
Es la unidad de concentración más utilizada por los químico y se define como el número de moles de soluto disueltos en un litro de disolución. V= litros de solución
Mol.- Es la cantidad de sustancia, que contiene tantas partículas químicas como átomos de carbono hay en exactamente 12 gr de carbono.
1.-¿ Qué molaridad se obtiene al disolver 80gr de hidróxido de sodio (NaOH) en medio litro de solución?
2.- Calcula la molaridad de una solución, si se tienen 100 gr de cloro (Cl2) en 500 mL de agua.
3.- Calcular la masa molar y su molaridad del sulfato de cobre (CuSO4).
SOLUCIONES ÁCIDAS Y BÁSICAS CONSIDERANDO EL GRADO DE ACIDEZ O DE BASICIDAD DE LA SOLUCIÓN.
Entre las familias más importantes en la química están los ácidos, las bases y las sales.
Acido.- Es una sustancia cuya disolución acuosa posee un sabor agrio, tiñe de rojo el papel tornasol azul, reacciona con los metales activos con desprendimiento de hidrógeno y neutraliza a las bases.
Base.- Sustancia cuya disolución acuosa posee un sabor amargo, tiñe de azul el papel tornasol rojo, tiene aspecto jabonoso y al reaccionar con los ácidos produce una sal más agua.
FUERZA DE LOS ACIDOS Y DE LAS BASES.
La fuerza de un ácido o de una base se determina por medio del PH, el cual representa la concentración de iones de hidrógeno que posee una solución por medio de una escala de valores que va del 0 al 14. Una solución puede ser ácida, básica o neutra.
Ácidos fuertes.- Se manejan en laboratorios con mucha precaución ya que provoca grandes quemaduras en la piel y daños en los ojos.
Bases débiles.- Producen solo algunos iones hidroxilo al reaccionar con agua. La base más débil es la solución acuosa de amoniaco (NH3) que se utiliza en los limpiadores de ventanas de uso doméstico.
Para medir el PH de soluciones.- Se utiliza tiras de papel universal, cuya coloración específica dependiendo del valor que le corresponde. Existen instrumentos llamados potenciómetros digital que mide el valor del PH. Es importante medir el PH en la sangre humana y debe medir entre 7.3 y 7.5 lo cual indica que es ligeramente básica. Si el valor del PH sube a 7.8 o baja 7.0 se producen alteraciones en el control de las reacciones que se llevan a cabo en las células provocando trastornos graves, incluso la muerte. Por eso se debe regular el PH para la cual se utiliza soluciones como ácido carbónico (H2CO3), bicarbonato de sodio (NaHCO3), fosfato de ácido mono sódico (Na H2PO4) y fosfato de ácido disódico (Na2HPO) así como ciertas proteínas.
Alimentos y bebidas que contienen ácidos.
-Las frutas cítricas: naranjas, limón, piña y toronja.
-Ácido acético: Cátsup y el vinagre
-Dióxido de carbono: Soda disuelta en agua a presión.
-Ácido clorhídrico: Se encuentra en el estomago: Ayuda a la descomposición de alimentos y convertirlos en proteínas y carbohidratos.







